La combustion du carbone
La combustion du carbone est une transformation chimique qui ne produit que du dioxyde de carbone. Elle nécessite du dioxygène.
Les réactifs de cette transformation sont le carbone (C) et le dioxygène (O2). Le produit est le dioxyde de carbone (CO2).
On peut écrire le bilan de cette transformation:
carbone + dioxygène —> dioxyde de carbone
On peut également écrire l’équation de réaction de cette transformation:
C + O2 —> CO2
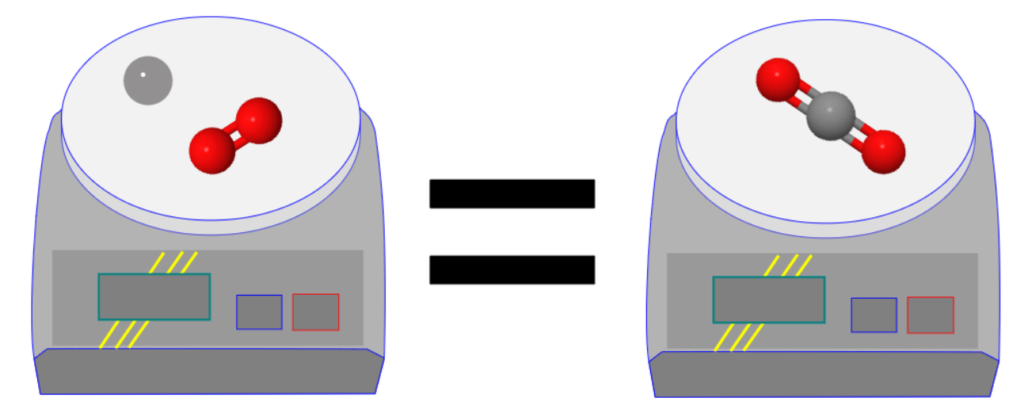
La combustion du méthane
La combustion du méthane est une transformation chimique qui nécessite du dioxygène et qui produit du dioxyde de carbone et de l’eau.
Les réactifs de cette transformation chimique sont le méthane (CH4) et le dioxygène (O2).
Les produits de cette transformation sont le dioxyde de carbone (CO2) et l’eau (H2O).
Le bilan de la transformation s’écrit:
Méthane + Dioxygène —> Dioxyde de carbone + Eau
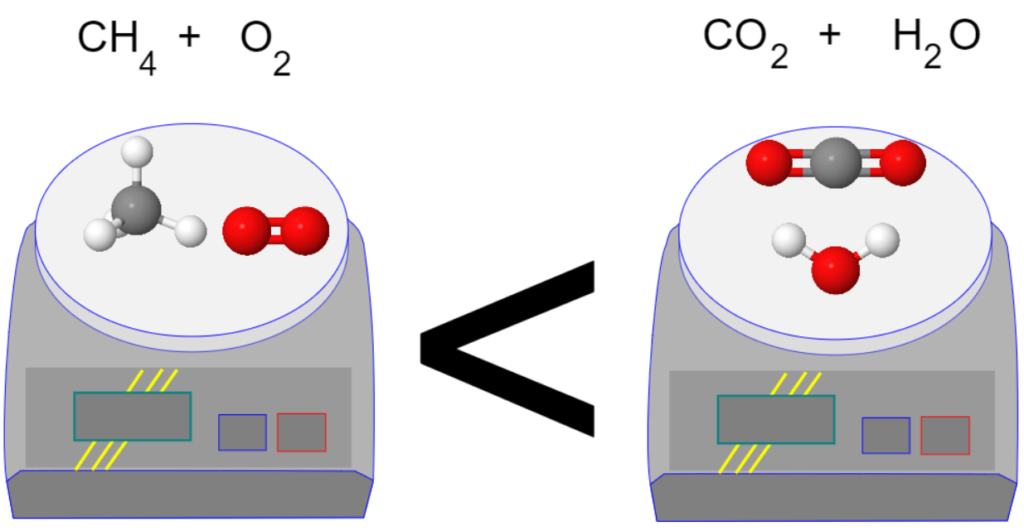
Nous pourrions être tenté d’écrire l’équation bilan de la transformation chimique de cette façon:
CH4 + O2 —> CO2 + H2O
Malheureusement, cela ne respecte pas la conservation de la masse.
En effet, dans les réactifs, il y a deux atomes d’oxygène (ils sont dans la molécule de dioxygène). Par contre, dans les produits, il y a trois atomes d’oxygène: deux dans la molécule de dioxyde de carbone et un dans la molécule d’eau. De la même façon, il n’y a pas les même nombres d’atomes d’hydrogène dans les réactifs et les produits.
Si on pouvait pesez les réactifs et les produits, on se rendrait compte qu’il n’y aurait pas conservation de la masse au cours de cette transformation.
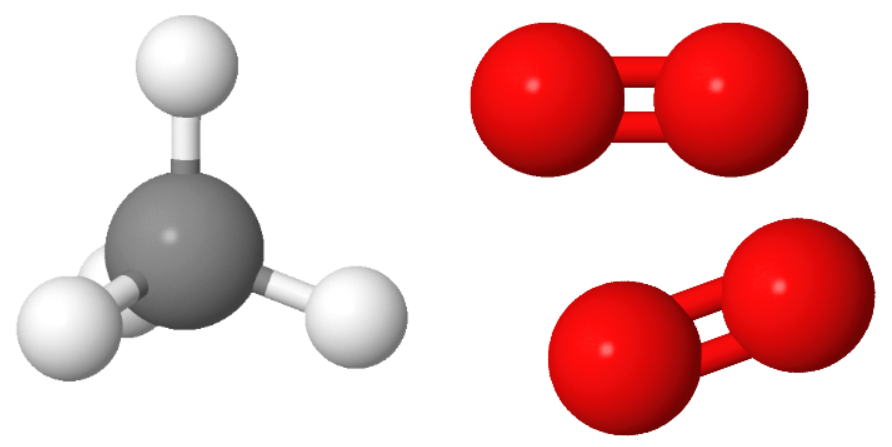
De plus, si on fabrique CO2 à partir des atomes des réactifs alors il reste des atomes d »hydrogène mais plus d’atomes d’oxygène pour former de l’eau.
De la même façon, si on fabrique H2O alors il reste des atomes pour former CO mais pas CO2. La combustion est donc incomplète: cela signifie qu’il manque du dioxygène.
Ajoutons une molécule de dioxygène:
Cette fois, il y a suffisamment d’atomes pour former exactement une molécule CO2 et deux molécules H2O.
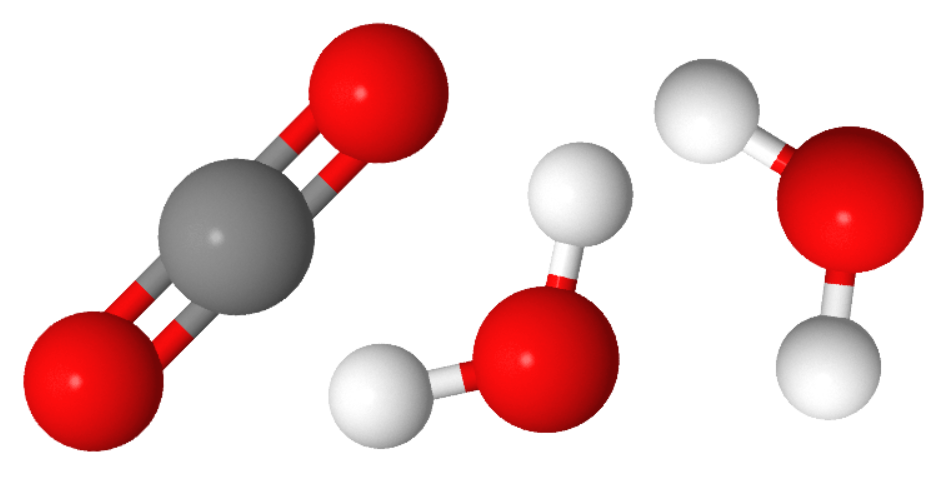
Finalement, il faut deux molécules de dioxygène pour brûler une molécule de méthane et il se forme deux molécules d’eau et une molécule de dioxyde de carbone.
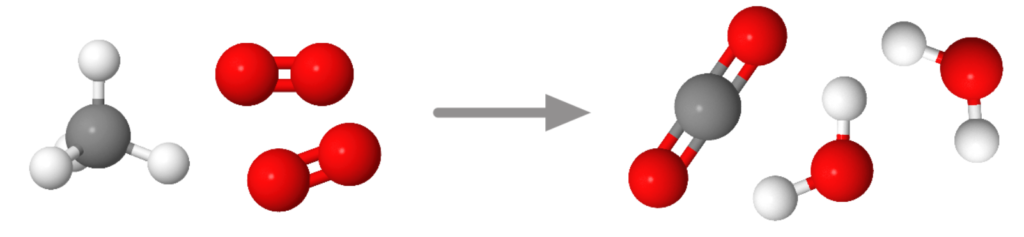
On peut maintenant écrire l’équation de la réaction:
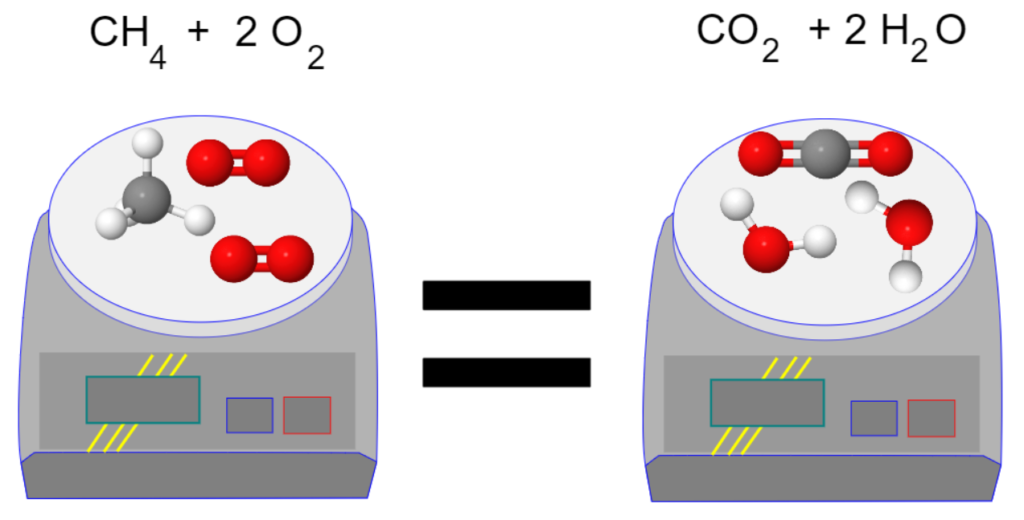
CH4 + 2 O2 —> CO2 + 2 H2O
L’équation est équilibrée car il y a les même nombre de chaque atome dans les réactifs et les produits.
Conclusion
Lors d’une transformation chimique, il y a conservation de la masse: cela s’explique par le fait que les atomes ne disparaissent pas et n’apparaissent pas. Ils se réorganisent pour créer de nouvelles molécules.

Antoine Laurent Lavoisier est souvent présenté comme le père de la chimie moderne, qui se développera à partir des bases et des notions qu’il a établies et d’une nouvelle exigence de précision offerte par les instruments qu’il a mis au point.
« Rien ne se perd, rien ne se crée, tout se transforme ».