Identification de l’ion Cu2+
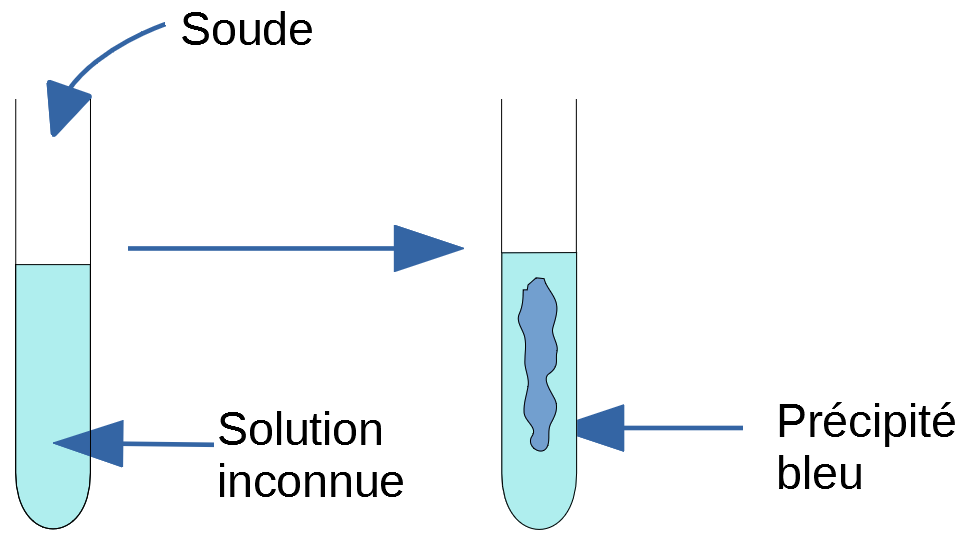
La vidéo suivante vous montre comment identifier l’ion Cuivre II Cu2+ dans une solution. Pour commencer, on y voit le test préliminaire qui montre que lorsqu’on ajoute de la soude dans une solution qui contient les ions Cu2+ il se forme un précipité bleu. Puis, j’utilise le test précédent pour déterminer si deux solutions inconnues contiennent l’ion Cu2+.
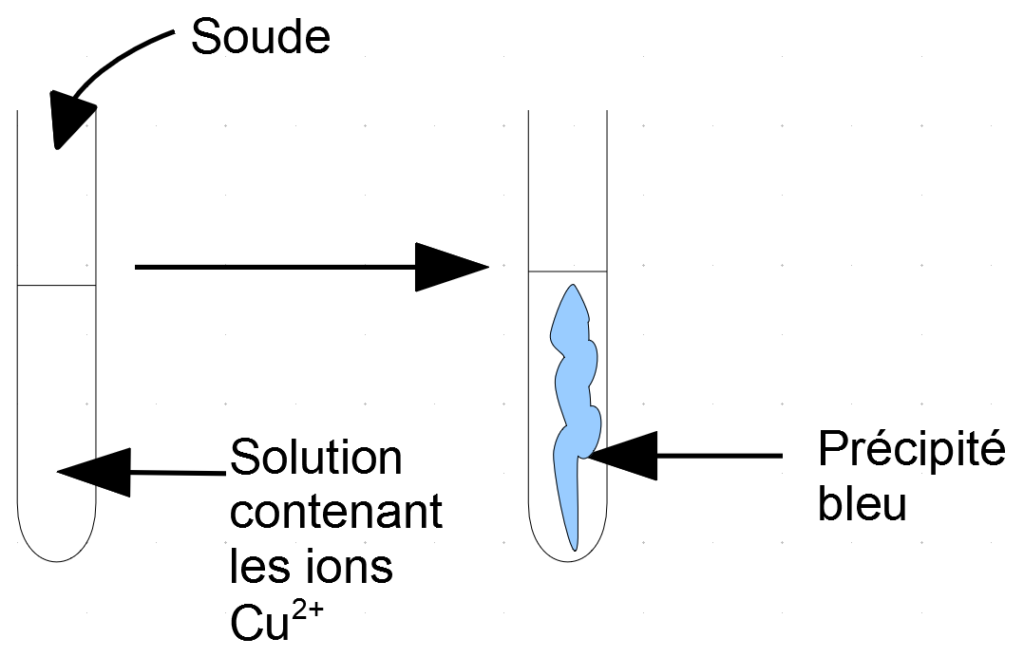
Lorsqu’on ajoute de la soude à une solution qui contient des ions Cu2+, il se forme un précipité bleu.
Identification des ions Fe2+ et Fe3+
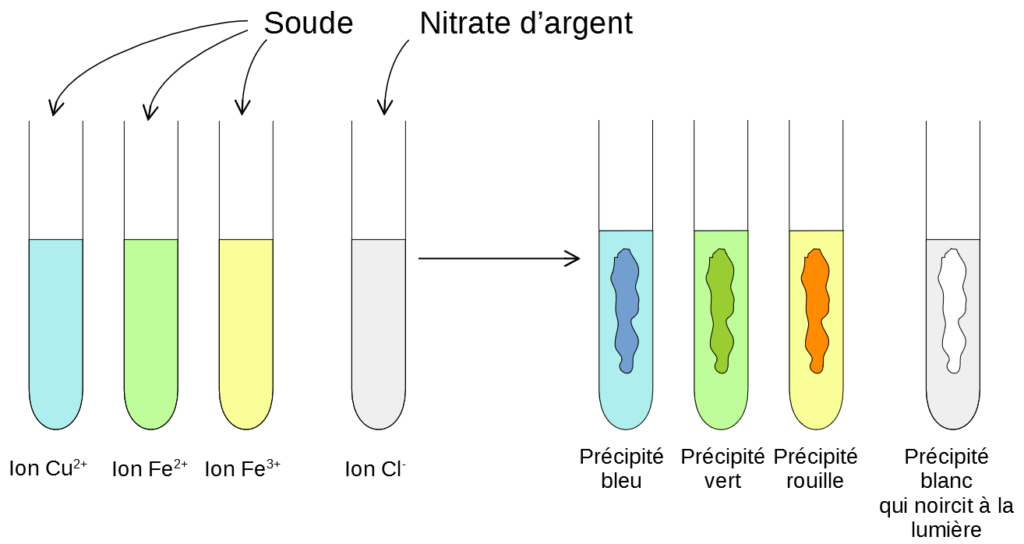
De la même façon, toujours avec de la soude, on peut identifier d’autres ions: l’ion ferreux Fe2+ et l’ion ferrique Fe3+.

Les tests se déroulent de la même façon mais on obtient des précipités vert avec Fe2+ et des précipités couleur rouille/ rouge brique avec Fe3+.
Identification de l’ion Cl–
Pour identifier l’ion chlorure Cl–, on utilise un autre réactif: le nitrate d’argent. Lorsqu’on ajoute quelques gouttes de nitrate d’argent à une solution contenant des ions Cl–, il se forme un précipité blanc qui noircit à la lumière. Inversement, si il se forme un précipité blanc (qui noircit à la lumière) lorsqu’on ajoute du nitrate d’argent à une solution alors cette solution contient des ions chlorure Cl–.

Bilan

Un peu d’histoire
Le nom « ion » a été donné en 1834 par Michael Faraday, pour désigner les espèces chimiques responsables de la conductivité électrique dans les solutions. Faraday voulait expliquer le transport du courant dans les solutions d’électrolytes. Ce néologisme sert d’abord à désigner les espèces chimiques migratrices vers l’anode ou la cathode d’une pile ou d’une batterie : il provient simplement du grec iôn, participe présent du verbe ienai, aller.
https://fr.wikipedia.org/wiki/Ion